Porfirin tanımı ve yapısal özellikler
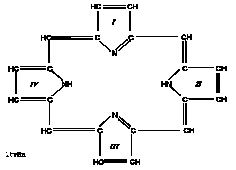
Porfirinler, porfirin halka sistemi içeren renkli maddelerdir. Porfirin halka sisteminin en basit temel maddesi pirol halkasıdır:
Dört pirol halkası metenil (=CH–, metin) köprüleri ile birbirine bağlanırsa porfin halka sistemi oluşur. Porfirinler, yapılarında içerdikleri çift bağlardan dolayı, 400 nm’de, Soret bandı diye tanımlanan absorpsiyon bandı oluştururlar. Yapılarında bulunan tek ve çift bağlar, porfirinlerin görünür ışığı absorplamalarına neden olur; U.V. etkisi altında pembe kırmızımsı renk verirler ki bu, porfirinlerin vücut sıvılarında ölçülmesini sağlayan en önemli özellikleridir.
Porfin halka sistemindeki pirol halkalarına porfobilinojendeki gibi çeşitli yan zincirlerin eklenmesiyle porfirin halka sistemi oluşur. Porfirinler, yan zincir içermeyen dört pirol halkasından kurulu kapalı bir yapı olan porfin maddesinin türevleri olarak tarif edilebilirler. Porfobilinojenler, porfirinlerin ön maddesi olarak kabul edilirler.
Porfirin halka sisteminde bulunabilen yan zincirler çeşitli olabilir ki bir porfirin halkasında bulunabilen yan zincirler veya takılar şunlardır:
Porfirinlerde porfirin halka sistemindeki her pirol halkasına bir büyük ve bir küçük takı veya yan zincir bağlanır. Asetil (A) ve metil (M) küçük takılardır; propiyonil (P), vinil (V), etil (E) ve oksietil (EOH) büyük takılardır. Bu yan zincirler, pirol halkalarının köşelerinde yer alırlar ve takıların diziliş sırasına göre çeşitli izomer şekiller oluşur ki doğada en çok tipI ve tip III izomer şekiller bulunur:
Porfirinler, porfirin halka sistemini oluşturan pirol halkalarına bağlı takıların türüne göre isimlendirilirler ve sınıflandırılırlar; ayrıca her sınıfın alt sınıfları vardır:
Porfirin sınıfı
|
Doğada bulunan örnekler
| |
Uroporfirinler
| ||
Koproporfirinler
| ||
Mezoporfirinler
| ||
Hematoporfirinler
| ||
Protoporfirinler
| ||
Döteroporfirinler
| ||
Uroporfirinler (URO) koproporfirinler (KOPRO) ve protoporfirinler (PROTO), üç ana porfirin türüdürler. Bunların çözünürlük ve atılma özellikleri farklıdır:
Porfirin halka sistemindeki pirol halkalarının N atomlarına Fe, Mg, Co, Zn, Ni, Cu gibi metallerin iyonlarının bağlanmasıyla metalloporfirinler diye tanımlanan çeşitli porfirin bileşikleri oluşur. Metalloporfirinlerdeki metal iyonları, porfirin halka sisteminin iki pirol halkasındaki disosiye olabilen H atomlarının yerini alır ve ayrıca diğer iki pirol halkasının tersiyer azot atomlarına koordinasyon bağları ile bağlanır:
En yaygın olarak bulunan biyolojik metalloporfirinler demir ve magnezyum içerenlerdir. Örneğin kanın kırmızı rengini veren hemoglobin, kasların kırmızı rengini veren miyoglobin, sitokromlar, sitokrom oksidaz, katalaz ve peroksidaz, demir-porfirin bileşikleridirler; bitkilerin yeşil rengini veren klorofil ise magnezyum-porfirin bileşiğidir.
Demir içeren metalloporfirinler, ya hem ya da hemin şeklinde olurlar. Hemler, ferro şeklinde demir (Fe2+)içerirler; heminler, ferri şeklinde demir (Fe3+) içerirler. Alkalilerin hidroksil grubu heminin demirine bağlanırsa hematin oluşur. Demir içeren metalloporfirinler bir proteine bağlanarak kromoproteinler diye bilinen bileşik proteinleri oluştururlar. Hemoglobin, miyoglobin, sitokromlar, sitokrom oksidaz, katalaz ve peroksidaz, demir-porfirinli bileşik proteinlerdir.
Hemoglobin
Hemoglobin, kanda eritrositlerde bulunan, kana kırmızı rengini veren, demir-porfirinli bir bileşik proteindir. 70 kg ağırlığında erişkin bir erkekte kan dolaşımında total olarak 750 g hemoglobin bulunur. %g olarak kandaki hemoglobin konsantrasyonunun normal değeri yetişkin erkek için %14-18 g , yetişkin kadın için %12-15 g , çocuk için %12-13 g , yeni doğan için % 21 g kadardır.
Hemoglobin molekülü 4 hem ve 1 globin içerir:
Hemoglobin, proteinlerin kuarterner yapısına iyi bir örnek oluşturur. Hemoglobinin molekül ağırlığı 68 kDa kadar ve molekül çapı 5,5 nm kadardır. Hemoglobinin molekül ağırlığının %96’sını globin kısmı, %4’ünü hem kısmı oluşturur.
Hemoglobinin protein komponenti olan globin, glisince fakir bazik amino asitlerce zengin bir proteindir; tetrahedron şekilde düzenlenmiş 4 polipeptit zincirden yapılmıştır. Çeşitli hemoglobin tiplerinde bulunabilen polipeptit zincirleri a-zincir, b-zincir, g-zincir, d-zincir olmak üzere dört tiptir. Hemoglobindeki a zinciri fetal yaşamda 3.aydan önce, b ve g zincirleri 3.ayda sentezlenmeye başlar. Ayrıca embriyonik gelişme döneminde sentezlenen 141 amino asitten oluşan zeta (x ) zinciri ile 146 amino asitten oluşan epsilon (e ) zinciri de tanımlanmıştır. a-zincirde 7 ve b-zincirde 8 segment bulunur. Segmentler, A’dan H’ye kadar harflerle isimlendirilirler; a-zincirde D segmenti yoktur. Her bir segment 7-20 amino asitten oluşur. Ayrıca a1-b1 arasında 30 amino asit kalıntısı vardır; a1-b2 arasında 19 amino asit kalıntısı vardır. Hemoglobindeki hem grubu, globindeki polipeptit zincirlerde F ve E heliksler arasında histidin kalıntılarına bağlı olarak yer alır. a-zincirde F8’deki 87.histidin ile b-zincirde F8’deki 92.histidinler, proksimal histidin olarak tanımlanırlar:
Çeşitli hemoglobin tiplerinde bulunabilen a-zincir, b-zincir, g-zincir ve d-zincirin genel yapı özellikleri şöyledir:
Globindeki polipeptit zincir tipleri
|
Yapı özellikleri
|
a-zincir
|
141 aminoasitten yapılmıştır; C-terminalinde arjinin içerir, N-terminalinde valin-lösin içerir.
|
b-zincir
|
146 amino asitten yapılmıştır; C-terminalinde histidin içerir, N-terminalinde valin-histidin-lösin içerir.
|
g-zincir
|
146 amino asitten yapılmıştır; b-zincirden farkı, 6. amino asidin glutamik asit yerine lizin olmasıdır.
|
d-zincir
|
146 mino asitten yapılmıştır; b-zincirden farkı, 16. amino asidin glisin yerine arjinin olmasıdır.
|
Türlere özel hemoglobin tipleri, molekülündeki globinin içerdiği polipeptit zincirleri bakımından birbirlerinden farklıdırlar.
Hemoglobindeki 4 hemin her biri bir protoporfirin III ve bir Fe2+ içerir:
Hemoglobin, molekülünde içerdiği toplam 4 adet Fe2+ sayesinde akciğerlerden dokulara O2 molekülü taşıyabilmektedir. 1 hemoglobin molekülü toplam 4 adet O2 molekülü bağlayarak taşıyabilir.
Fizyolojik hemoglobinler (normal hemoglobinler)
Fizyolojik hemoglobinler, erişkin bir şahsın kanındaki eritrositlerde bulunan HbA1, HbA2, HbF hemoglobinleridirler. Gower I, Gower II ve Portland olarak adlandırılan embriyonik hemoglobinler de tanımlanmıştır. Embriyonik hemoglobinler, gebeliğin 10.haftasından önce kaybolur ve fetüste bulunmaz.
HbA1: Globininde 2a ve 2b polipeptit zinciri içeren fizyolojik hemoglobindir. HbA1, erişkin bir şahsın eritrositlerinde bulunan hemoglobinin %97-98’ini oluşturur. Fetüste 20-35.haftalarda total hemoglobinin %10’unu HbA1 oluşturur. HbA1, alkalilere dirençli değildir.
HbA1’in globininin b-polipeptit zincirindeki a-amino grubuna enzimatik olmayan bir reaksiyonla kovalent bir şekilde karbonhidrat bağlanması sonucu glikozile hemoglobinler oluşur. Glikozile hemoglobin oluşumu, yaş ve açlık kan şekeri artışıyla birlikte artar. HbA1a (HbA3), HbA1b, HbA1C, HbA1d, HbA1e bilinen glikozile hemoglobinlerdir. Bu hemoglobinler normalde çok az bulunurlar ve hiçbiri toksik değildir. Glikozile hemoglobinlerden en sık rastlananı, HbA1C’dir. HbA1C’de b zincirlerindeki genellikle valin amino asidine fruktoz bağlanmıştır; glukozun fruktoza dönüşümü, amadori düzenlenim diye bilinen yeniden düzenlenme reaksiyonu sonucu gerçekleşir. HbA1C, erişkin sağlıklı bir insanda total hemoglobinin %5-8’ini oluşturur; diyabetli kişilerde glikozile hemoglobin düzeyi total hemoglobinlerin %8’inin üzerine çıkarak normalin 2-3 misli olabilir. Hemoglobinlerin glikozilasyonu, eritrositlerin 120 günlük yaşam süresince devam eder; oluşan miktar, etkileştikleri kan glukoz miktarıyla orantılıdır ki uzun süreli hiperglisemide artar. Kan HbA1C düzeyi, diyabetin takibinde ve kan glukoz düzeyinin regülasyonunda önemli bir kimyasal parametredir.
HbA2: Globininde 2a ve 2d polipeptit zinciri içeren fizyolojik hemoglobindir. HbA2, erişkin sağlıklı bir şahsın eritrositlerinde bulunan hemoglobinin %0,5-2,5’ini oluşturur. HbA2, alkalilere dirençli değildir.
HbF: Globininde 2a ve 2g polipeptit zinciri içeren, primitif hemoglobin (HbP) diye de bilinen fizyolojik hemoglobindir. HbF’nin g zincirinin 136.amino asidinin alanin veya glisin oluşuna göre iki tipi vardır. HbF, erişkin sağlıklı bir şahsın eritrositlerinde bulunan hemoglobinin %1’inden azını oluşturur. HbF, yeni doğanda total hemoglobinin %70-90’ını oluşturur. Doğumda total hemoglobinin %70-90’ını oluşturan HbF, 1.ayın sonunda %50-70, 2.ayın sonunda %25-30, 3.ayın sonunda %10-30, 3 yaşında %1, erişkinde %0,4’tür. HbF, alkalilere dirençlidir; 2,3-bisfosfogliserat (2,3-DPG) bağlamaz; oksijene affinitesi fazladır.
Anormal hemoglobinler ve hemoglobinopatiler
Hemoglobinopatiler, yapısal olarak farklı hemoglobin molekülünün yani anormal hemoglobinlerin üretilmesiyle karakterize hastalıklardır. Anormal hemoglobinlerin ortaya çıkmasına neden olan patolojiler çeşitlidir: 1) Hemoglobinin polipeptit zincirine bir veya daha fazla amino asit eklenebilir, zincirden amino asit çıkabilir veya zincirdeki amino asitler yer değiştirebilir. 2) Globin zinciri üretiminde defekt olabilir; belli bir globin zinciri türü üretilmez. 3) Tip 1 ve tip 2’nin kombinasyonu olabilir. 4) Herediter persistant fetal hemoglobinemi de tanımlanmıştır; asemptomatiktir. Anormal hemoglobinler, oksijen taşıma kapasitesi azalmış olan hemoglobinlerdir. Anormal hemoglobinlerin pek çok çeşidi vardır ki bunlar, keşfedildiği yer, ilk keşfedilen ailedeki isimler ya da yer değişimi olan amino asidin adı temel alınarak isimlendirilmektedirler.
Hb S: HbA1’in b-zincirlerindeki 6. amino asit glutamik asit değil de valin olan hemoglobindir. Oksijensiz ortamda Hb S’in solubulitesi azalır; Hb S, çubuk benzeri lifler ve fibröz agregatlar oluşturur. Hb S içeren eritrositler orak şeklinde görüntü oluştururlar ve kolayca parçalanırlar. Fibröz agregat oluşumu, 2 b zincirindeki etkileşmeden kaynaklanmaktadır. Hb S deoksijenize olduğunda çözünürlük azalışı viskozitenin artışına neden olur; oraklaşmış eritrositlerin de ince kapillerlerde dolaşımı yavaşlatmasıyla tromboz ve emboliler gelişebilir. Hb S, orak hücreli anemi ( Hb S hastalığı) olarak tanımlanan hemoglobinopatinin ortaya çıkmasına neden olur.
Orak hücreli anemi ( Hb S hastalığı), otozomal resesif kalıtılır; homozigotlarda hemolitik anemi ortaya çıkar. Heterozigot taşıyıcılarda asemptomatiktir; ancak pO2 25 mmHg’nın altına düştüğünde oraklaşmış hücreler dalakta toplanırlar, dolaşımı bozarlar, ağrılı damar tıkanıklıklarına neden olurlar. Orak hücreli anemi ( Hb S hastalığı), Amerika, Afrika, Hindistan, Arabistan ve Akdeniz ülkelerinde görülür. Heterozigot orak hücreli anemi hastaları, sıtma paraziti olan plasmodyum falsiparuma karşı dirençlidirler; sıtmaya karşı hassasiyetleri azdır. Bu kişilerde eritrositlerin yaşam süresi normalden kısadır; parazit, eritrosit içindeki gelişimini tamamlayamaz. Pl.falsiparum eritrosit içinde büyürken intrasellüler pH’da düşme ve H2O2 oluşumunda artışa neden olur. Eritrosit içi pH’da düşme oraklaşmayı artırır ve H2O2 hücre membran yapılarını bozar; eritrositlerin içinde oldukça fazla bulunan K+ iyonları hücre dışına sızar; K+ iyonlarının eritrosit içinde azalması sıtma parazitini öldürür.
Hb C: HbA1’in b-zincirlerindeki 6. amino asit glutamik asit değil de lizin olan hemoglobindir. Hb C, hemoglobin C hastalığı olarak bilinen hemoglobinopatinin ortaya çıkmasına neden olur. Homozigot hemoglobin C hastalarında, orta derecede kronik hemolitik anemi gözlenir.
Bir kısmı b globinde orak hücre mutasyonu gösterirken bir kısmı Hb C özelliğinde olan bir hemoglobinopati, hemoglobin SC hastalığı olarak tanımlamaktadır.
Hb Gun Hill: Globini 4 hem değil de 2 hem içeren anormal hemoglobindir. Hb-Gun Hill molekülünde b polipeptit zincirleri, hem bağlanması için gerekli amino asit kalıntılarını içermez; moleküle hem ve dolayısıyla O2 bağlayamazlar; yalnızca a polipeptit zincirleri hem ve dolayısıyla O2 bağlayabildiklerinden Hb-Gun Hill’in oksijen taşıma kapasitesi yarı yarıya azalmıştır.
Hb H ve Hb Bart: Hb H, globini a-zinciri içermeyen, 4b-zinciri içeren hemoglobindir; Hb Bart ise globini a-zinciri içermeyen, 4g-zinciri içeren hemoglobindir. Hb H ve Hb Bart, a-talasemili hastaların kanında saptanır.
Talassemiler, herediter hemolitik hastalıklardır; insanlarda tek gen defektinin görüldüğü en sık rastlanan hastalık grubunu oluştururlar. Talassemilerde, normalde uyum içinde sentezlenen a ve b zincirlerinden biri sentezlenmez veya azalmış olarak sentezlenir. a0 veya b0, a+ veya b+ gibi, defektli globin zinciriyle anılan çeşitli talassemiler tanımlanmıştır.
a-talassemilerde a globin zincirlerinin sentezi ya hiç olmaz ya da azalmıştır. Her birey, a globin geni için, her bir 16.kromozomda 2 adet olmak üzere dört kopya içerir; bu nedenle zincir eksiklik düzeyleri çeşitlidir. Dört genden biri defektli ise, “silent carrier” terimi kullanılır; çünkü hastalığın varlığına ait hiçbir belirti yoktur. İki a globin geninde defekt varsa “a talassemi trait” söz konusudur. Eğer üç a globin geninde defekt varsa “hemoglobin H hastalığı” söz konusudur; orta dereceden ciddiye doğru değişen hemolitik anemi tablosu sergilenir. Eğer a globin genlerinin dördü de defektli ise fetal ölümle sonuçlanan “hidrops fetalis” ortaya çıkar; çünkü a globin zincirleri, HbF oluşumu için de gereklidir. Etkilenmeyen g ve b zincirlerinin sentezleri devam eder ve yeni doğanda g4 (Hb Bart) veya b tetramer (Hb H) oluşur. Bu tetramerlerdeki alt birimler hem-hem etkileşmesi göstermezler; oksijene affiniteleri yüksek, oksihemoglobinin dissosiasyon eğrileri hiperboliktir ve bu nedenle dokulara oksijen taşıma kapasiteleri düşüktür.
b-talassemilerde b globin zincirlerinin sentezi azalır veya olmaz; a globin zincir sentezi normaldir. Ancak a globin zincirleri stabil tetramer oluşturmazlar; presipite olurlar ve hücreler, olgunlaşmadan ölürler. Her birey, b globin geni için, her bir 11.kromozomda 1 adet olmak üzere iki kopya içerir. Tek gen defekti olduğunda “b-talassemi minör” söz konusudur; her iki b globin geninde defekt olduğunda “b-talassemi majör” söz konusudur. b globin geni, fetal yaşamın geç dönemine kadar expresse edilmez; bu nedenle b-talasseminin belirtileri doğumdan sonra gözlenir. b-talassemi majörde hastalar, yaşamın bir veya ikinci yılında çiddi anemi tablosu sergilerler; bu hastalar için düzenli kan transfüzyonu gerekir; kronik kan tranfüzyonu nedeniyle hastalarda demir yüklenmesine bağlı “hemosiderozis” tablosu gelişir. b-talassemi majör hastalarında 15-25 yaşları arasında ölüm olur. Tedavi için, kemik iliği replasman tedavisi uygulanabilmektedir.
Hb M (Saskanon): HbA1’in b-zincirlerindeki 63. amino asit histidin değil de tirozin olan hemoglobindir; b-zincirlerine O2 bağlayamaz; oksijen taşıma kapasitesi yarı yarıya azalmıştır.
Hb M (Osaka): HbA1 ve HbA2’nin a-zincirlerindeki 58. amino asit histidin değil de tirozin olan hemoglobindir; a-zincirlerine O2 bağlayamaz; oksijen taşıma kapasitesi yarı yarıya azalmıştır.
Hemoglobin bileşikleri
Oksihemoglobin (HbO2)
Oksihemoglobin, hemoglobin molekülündeki 4 Fe2+’e akciğerlerde birer O2 molekülü bağlanması sonucu oluşan hemoglobin bileşiğidir. Bir hemoglobin molekülü, 4 O2 molekülü bağlayabilmektedir. Hemoglobinin hem grubundaki demir, Fe2+ şeklindedir ve bu şekilde oksijeni reversibl olarak bağlar.
Hemoglobine oksijen bağlanmasına, hem grubunun çevresindeki biçimsel değişiklikler eşlik eder. Hemoglobine oksijen bağlanmasıyla, dört alt ünitedeki karboksil uçları arasındaki tuz bağları parçalanır ve böylece sonraki oksijenin bağlanmasını kolaylaşır; çünkü ikinci oksijenin bağlanması için daha az tuz bağının parçalanması gerekir. Hemoglobine reversibl olarak oksijen bağlanması sırasında alt üniteler arasındaki ilişkinin %60’lık bölümü değişmeden kalırken %35’lik bölümü kayar; oksijen cep içine girerken Fe oksijene doğru hareket eder ve bağlı olduğu proksimal histidini de cepe çeker; F heliks hareket ederken tuz köprüleri kopmaya başlar. Hemoglobinin böyle oksijenli formu, R (Relaks) form olarak tanımlanır:
Oksijen, hemoglobinin R formuna 100 kez daha kolay bağlanır; ilk oksijen bağlanmasıyla oluşan konfigürasyon değişikliği, diğer oksijenlerin daha rahat bağlanmasını sağlar. Oksijenin demire bağlanması sırasında demir Fe2+ şeklinden Fe3+ şekline oksitlenmediğinden, oksijenin hemoglobine bağlaması bir oksidasyon değildir. Bu nedenle hemoglobin molekülüne akciğerlerde O2 moleküllerinin bağlanması olayı, hemoglobinin oksijenasyonu olarak tanımlanır. Bir hemoglobin molekülü, oksijenasyon olayı sonucunda 4 O2 molekülü bağlayabilmektedir.
Hemoglobinin oksijene affinitesi, oksijenin kısmi basıncına bağlıdır. pO2 100 mmHg ve daha fazla olduğunda hemoglobinin oksijene tamamen doyduğu veya hemoglobinin oksijenle % satürasyonunun %100 olduğu ifade edilir ki oksijenle % satürasyonu %100 olan hemoglobinin 1 gramına 1,34 mL O2 bağlanmıştır. Hemoglobinin oksijenle % satürasyonunun hayatla bağdaşabilen minimum değeri, 20 mmHg’lık pO2’de %30 kadardır.
Erişkin sağlıklı bir insan kanında hemoglobin konsantrasyonu yaklaşık %14,5 gram kadar olduğu kabul edilirse, bu durumda 100 mL kanda hemoglobin ile taşınabilecek oksijen miktarı, 1,34 x 14,5 = 19,43 mL olarak hesaplanır. Buna fiziksel olarak çözünmüş olan 0,393 mL oksijen eklenince, hemoglobin düzeyi %14,5 gram olan bir sağlıklı erişkin insanın kanının 100 mL’sinde yaklaşık 20 mL oksijen taşınabildiği, bir başka deyişle hemoglobin düzeyi %14,5 gram olan bir sağlıklı erişkin insanın kanının O2 taşıma kapasitesinin yaklaşık 20 ml O2 / dL kan olduğu hesaplanır.
pO2 değişimine karşı hemoglobinin oksijenle % satürasyonunu gösteren grafiklere hemoglobinin satürasyon eğrisi veya oksihemoglobinin dissosiasyon eğrisi denir. Oksihemoglobinin dissosiasyon eğrisi, 7,4 pH, 37oC ve 35-40 mmHg pCO2’ ında sigmoid şeklindedir:
Arteriyel kandaki 95-100 mmHg’lık pO2’nda hemoglobinin oksijen ile % satürasyonunun %96-98 olduğu saptanmıştır. pO2 azalacak olursa, pO2 yaklaşık 50 mmHg’ya düşünceye kadar hemoglobinin oksijenle % satürasyonu çok yavaş azalır. pO2’ nın 50 mmHg’nın altında olduğu durumlarda, pO2’ nın azalması karşısında hemoglobinin oksijenle % satürasyonunda hızlı bir düşüş saptanır ve bu, hemoglobinin yükünü atma (boşaltma) gerilimi diye tanımlanır.
Hemoglobinin oksijen ile yarı yarıya doymuş olduğu kısmi oksijen basıncı, P50 olarak gösterilir. İnsan hemoglobinleri için P50, 7,4 pH, 37oC ve 35-40 mmHg pCO2’ ında, HbA için 27 mmHg ve HbF için 20 mmHg bulunmuştur. HbA ile HbF arasındaki P50 farkı, plasentanın HbA’dan oksijen çekmesini sağlar.
Akciğerlerde pO2 80 mmHg’ya kadar düşse bile hemoglobinin oksijenasyonunda herhangi bir önemli azalma olmadığı halde dokularda pO2’in 40 mmHg’ya düştüğü durumlarda oksihemoglobinin dissosiasyonu ile dokulara oksijen bırakılır ki kanın dokular içinden bir kez geçişinde kandaki oksijen miktarı 20 ml/dL’den 15 mL/dL’ye düşer; 100 mL kan ile, akciğerlerden dokulara 5 mL oksijen taşınır.
Akciğerlerde oksijenasyon olayı sonucunda hemoglobine bağlanan oksijen, diğer dokularda deoksijenasyon olayı sonucunda hemoglobinden ayrılır:
Dokularda pO2 40 mmHg kadar olduğundan, akciğerlerden gelen kanda oksijenle satürasyonu %75 olan hemoglobin, oksijeni dokulara bırakabilir. Deoksijenasyon sırasında hemoglobin molekülü 1 veya 2 oksijen molekülünü bırakınca, Fe yeniden halka düzleminin üstüne kayar; tuz köprüleri yeniden oluşur. Hemoglobinin böyle oksijenzis formu, T (Taut form, gergin form) olarak tanımlanır.
Akciğerlere gelen venöz kanda pO2 yaklaşık 40 mmHg ve oksijenle satürasyonu %66 alveollerde pO2 ise 104 mmHg kadar olduğundan, hemoglobin akciğerlerde yeniden oksijenlenir.
Oksijenize hemoglobin (oksihemoglobin) parlak kırmızı, deoksijenize hemoglobin (deoksihemoglobin) koyu kırmızı olduğundan kanın oksijenlenmesinde bir azalma ve bunun sonucu olarak deoksijenize olmuş hemoglobinde artış, deri ve mukozalara karakteristik mavimtrak bir renk verir ki bu durum siyanoz olarak tanımlanır. Siyanoz, kapiller kan hemoglobininin %5 g’ın üzerinde olduğu durumlarda görülebilir. Kapiller kan hemoglobininin %5 g’ın altında olduğu ağır anemilerde, deoksijenize hemoglobin artmış olsa bile siyanoz görülmeyebilir.
Oksihemoglobinin dissosiasyon eğrisi, hemoglobinin oksijenasyonu ve deoksijenasyonu ile ilgili özellikler hakkında bilgi verir. Örneğin oksihemoglobinin dissosiasyon eğrisinin sağa kayması hemoglobinin akciğerlerde daha az oksijenleneceğini dokularda kolayca deoksijenize olabileceğini sola kayması ise hemoglobinin akciğerlerde daha çok oksijenleneceğini dokularda kolayca deoksijenize olamıyacağını ifade eder.
Oksihemoglobinin dissosiasyon eğrisi, ısı veya sıcaklık, elektrolitler, pH veya pCO2, 2,3-bisfosfogliserat (2,3-DPG; DPG; 2,3-BPG), HbF gibi bazı faktörlerden etkilenir. Bu faktörler ve oksijenin parsiyel basıncı, hemoglobinin oksijenle bağlanmasını etkileyen faktörler olarak da incelenirler:
1) Isı veya sıcaklık
Isı veya sıcaklık artışı, oksihemoglobinin dissosiasyon eğrisini sağa kaydırır; hemoglobinin oksijen ile % satürasyonunu azaltır. 100 mmHg’lık pO2’de hemoglobinin oksijenle % satürasyonu 25oC’de %98 olduğu halde 38oC’de %93 kadardır. Oksihemoglobin oksijenini dokulara 38oC’de daha kolay verir. Normal sıcaklığın altında bağlanma daha sıkı olur; sıcaklık artışında bağlar zayıflar ve oksijen ayrılışı artar. Bu, fizyolojik olarak yararlı bir mekanizmadır; ateşli hastalıklarda metabolizma hızı da artar ve ısı artışıyla oksijen salınmasının artışı bunun için gerekli oksijeni sağlar. Egzersizde de kasların ısısı artar; gene metabolizma hızlandığı için oksijen ihtiyacı artar.
2) Elektrolitler
Klorür gibi anyonlar, hemoglobinin oksijen ile % satürasyonunu azaltır; oksihemoglobinin dissosiasyon eğrisini sağa kaydırır. Oksihemoglobin oksijenini klorür gibi anyonların bulunduğu ortamda daha kolay verir.
3) pH veya pCO2
pCO2, hücrede 46 mmHg, interstisyel aralıkta ve venöz kanda 45 mmHg, arter kanında 40 mmHg kadardır. Normal şartlarda dokudan akciğerlere CO2, kan içinde 0,3 mL CO2/100 mL kan olarak taşınır. Egzersiz sonrası dokularda oluşan CO2 artar ve bu, venöz CO2 konsantrasyonunu ve asiditeyi artırır.
Karbondioksit artışı, oksihemoglobinin dissosiasyon eğrisini sağa kaydırır ki bu etki, Bohr etkisi olarak tanımlanır. Bohr etkisi veya oksihemoglobinin dissosiasyon eğrisinde sağa kayma şu durumlarda gözlenir: 1) Karbondioksit kısmi basıncında artış. 2) H+ iyonları konsantrasyonunda artış veya pH’da düşme (asidoz). 3) Isıda artış ki ATP artışıyla birlikte olabilir. 4) 2,3-bisfosfogliserat (2,3-BPG; 2,3-DPG) artışı. 5) Pirüvat kinaz eksikliği, hipoksi veya yüksek irtifa ki laktat artışıyla birliktedir. 10 m irtifada pO2 95 mmHg ve hemoglobinin oksijenle satürasyonu %100 olduğu halde 4500 m irtifada pO2 45 mmHg ve hemoglobinin oksijenle satürasyonu %82’dir. Oksihemoglobinin dissosiasyon eğrisinde sağa kayma, P50’de yükselmeye ve hemoglobinin oksijene olan ilgisinin azalmasına neden olur; dokulara oksijen bırakılması artar; herhangi bir pO2’de hemoglobinin oksijen ile doygunluğu azalır. Oksihemoglobinin dissosiasyon eğrisinde sağa kayma, dokular tarafından alınan oksijen miktarını artırır.
Karbondioksit azalması, oksihemoglobinin dissosiasyon eğrisini sola kaydırır ki bu etki, Haldene etkisi olarak tanımlanır. Haldene etkisi veya oksihemoglobinin dissosiasyon eğrisinde sola kayma şu durumlarda gözlenir: 1) Karbondioksit kısmi basıncında azalma. 2) H+ iyonları konsantrasyonunda azalma veya pH’da artma (alkaloz). 3) Isıda azalma. 4) 2,3-bisfosfogliserat (2,3-BPG; 2,3-DPG; DPG) düzeyinde düşme. 5) HbF düzeyinde artma. Oksihemoglobinin dissosiasyon eğrisinde sola kayma, P50’de düşmeye ve hemoglobinin oksijene olan ilgisinin artmasına neden olur; dokulara oksijen bırakılması azalır; herhangi bir pO2’de hemoglobinin oksijen ile doygunluğu artar. Oksihemoglobinin dissosiasyon eğrisinde sola kayma, dokular tarafından alınan oksijen miktarını azaltır.
4) 2,3-Bisfosfogliserat (DPG; 2-3-BPG)
2,3-BPG, glukozun glikoliz yolunda yıkılımı sırasında, 3-fosfogliseratın fosfogliserat mutaz etkisiyle 2-fosfogliserata dönüşümü sırasında oluşmaktadır ve fosfogliserat mutazın kofaktörü olarak görev görür. 2,3-BPG, eritrosit içi pH’da -5 yüklüdür; deoksihemoglobindeki +8 yüklü 8 amino aside bağlanır ki 1 deoksihemoglobin 1 mol 2,3-BPG bağlar. 2,3-BPG, hemoglobinin allosterik inhibitörüdür; hemoglobinin oksijene affinitesini azaltır; oksihemoglobinin dissosiasyon eğrisini sağa kaydırır.
2,3-BPG, hipoksiye adaptasyonda hassas kontrolü yapar; astım hastalığı, yüksek irtifaya çıkmak gibi hipoksik koşullarda miktarı artar ve böylece düşük oksijen basınçlarında dokuların oksijenlenmesi sağlanır. Hipoksik koşullarda 2,3 BPG düzeyinin hızla değişmesinde rol oynayan çeşitli faktörler vardır: a) Deoksihemogbine 2,3 BPG bağlanmasıyla 2,3 BPG düzeyi düşer ve 2,3 BPG sentezi artar. Hemoglobinin oksijen doygunluğunda azalma da 2,3 BPG’nin hemoglobine bağlanmasına ve dolayısıyla 2,3 BPG düzeyinin düşmesine sentezinin artmasına neden olur. 2,3 BPG, deoksihemoglobine bağlandığı halde oksihemoglobine bağlanmaz. b) Anaerobik glikoliz nedeniyle eritrosit içi pH’da düşme ile, deoksihemoglobin konsantrasyonu ve 2,3 BPG’nin hemoglobin ile bağlı miktarı artar; bu da 2,3 BPG sentezinin artışına neden olur.
2,3 BPG yetmezliğinde dokulara oksijen bırakılması azalır ve orta derecede eritrositoz olur; ancak klinik bulgu görülmez. Transfüzyon için alınıp saklanan kanlarda 2,3 BPG konsantrasyonu ve ATP zamanla azalır ve bu kanlarda hemoglobinin oksijene affinitesi artacağı için, dokulara oksijen bırakılması azalır. Sık sık kan transfüzyonu yapılan hastalarda, hemoglobin değeri normal olmasına karşın doku hipoksisi olabilir. Transfüzyon için alınan kan örneklarini sitrat-fosfat-dekstroz üzerine almak suretiyle 2,3 BPG konsantrasyonu korunur; hatta ortama dihidroksiaseton fosfat (DHAP) eklenmesiyle 2,3 BPG’ın ömrü daha da uzatılır.
5) HbF
HbF, 2,3-BPG’yi daha gevşek olarak bağlar ve dolayısıyla 2,3-BPG HbF’in oksijene affinitesinin artmasına neden olur. HbF artışı, oksihemoglobinin dissosiasyon eğrisini sola kaydırır.
Karbaminohemoglobin
Karbaminohemoglobin, hemoglobindeki globinin serbest a-amino gruplarına reversibl olarak CO2 bağlanmasıyla oluşan hemoglobin bileşiğidir. Karbamino grubu, hemoglobinin oksijene olan ilgisini azaltır ki bu etki, pH düşüşünden bağımsızdır. CO2, deoksijenize hemoglobine oksihemoglobinden daha çok bağlanır ve böylece dokulardan akciğerlere hemoglobin ile taşınabilir. pCO2, hücrede 46 mmHg, interstisyel aralıkta ve venöz kanda 45 mmHg, arter kanında 40 mmHg kadardır. Normal şartlarda dokudan akciğerlere CO2, kan içinde 0,3 mL CO2/100 mL kan olarak taşınır.
Kandaki CO2’in %15-20’si karbaminohemoglobin bileşimindedir; %5’i plazmada serbest veya H2CO3 halindedir; %75-80’i de HCO3- şeklindedir. Egzersiz sonrası dokularda oluşan CO2 artar ve bu, venöz CO2 konsantrasyonunu ve asiditeyi artırır. Kandaki başlıca tampon hemoglobindir. Hemoglobinde yoğun olarak histidin bulunur ki histidinin imidazol grubu için pKa 7,3’tür. Dokularda oksijen konsantrasyonu düşüktür; hemoglobin, oksijeni bırakır ve H+ bağlar ki hemoglobin protonlandığında His146, Asp94 ile tuz köprüsü yapar ve T form stabilize olur. Protonlarda artış oksijen salınmasına neden olurken oksijende artış protonların salınmasına neden olur. Akciğerlerde hemoglobinin oksijenlenmesiyle, peptit zincirindeki bazı asit gruplarından proton salıverilişi olur. Tam kanda fizyolojik şartlarda deoksihemoglobine bağlanan her oksijen molekülü için 0,31 mol hidrojen salınır. Parçalanan tuz höprülerinden kaynaklanan bu protonlara Bohr protonları denir ki bunların %40’ı b zincirindeki His146’dan, %25’i N-terminal amino gruplarından, %35’i diğer amino asitlerden kaynaklanır. Salınan H+, HCO3- ile birlikte H2CO3 oluşturur; H2CO3 de CO2 ve H2O oluşturur.
Dokulardan kana geçen karbondioksit, karbonik anhidraz etkisiyle eritrositte HCO3- konsantrasyonunun artmasına neden olur. Eritrositte artan HCO3- plazmaya diffüze olurken elektrostatik yük dengesini sağlamak üzere klorür (Cl-) de eritrositlere girer. Bu taşınmada bikarbonat-klorür taşıyıcı protein rol oynar ve olay, klorür kayması olarak bilinir. Bu olay nedeniyle venöz kandaki eritrositlerde klorür düzeyi, arteriyel kandaki eritrositlerdekinden yüksektir. Akciğerlerde, dokulardaki olayın tersi olur; bikarbonat eritrosite girerken klorür plazmaya geçer:
Karboksihemoglobin (Hb×CO)
Karboksihemoglobin, oksihemoglobindeki O2 yerine karbonmonoksit (CO) geçmesi suretiyle oluşan hemoglobin bileşiğidir.
Hemoglobinin CO’e affinitesi O2’e affinitesinden 210 misli fazladır; ortamda oksijen ve karbonmonoksit eşit miktarlarda bulunduğunda hemoglobine tercihli olarak CO bağlanır ve anemik hipoksiye neden olur. Ortamda bulunan CO, oksijen taşımada kullanılabilecek hemoglobin miktarını azaltır; bu durumda kan akciğerlerde oksijenlenemez ve dokulara oksijen taşınamaz.
Solunum havasında CO bulunması, CO konsantrasyonuna ve havanın solunma süresine bağlı olarak değişen çeşitli zehirlenme belirtilerinin görülmesine neden olur: 1) Solunum havasında %0,02 oranında CO bulunması, baş ağrısı ve bulantıya neden olur. 2) Solunum havasında %0,1 oranında CO bulunması, baş ağrısı, baş dönmesi, bulantı ve taşikardi ve kan düzeyinin %4-6’ya yükselmesiyle 1 saatte bilinç kaybına, kan düzeyinin %10’a yükselmesiyle 4 saatte ölüme neden olabilir. 3) Solunum havasında %0,4 oranında CO bulunması, baş ağrısı, baş dönmesi, bulantı, taşikardi, yorgunluk, dispne ve kan düzeyinin %20-30’a yükselmesiyle 1 saatten daha kısa sürede ölüme neden olabilir. 4) Solunum havasında %1 oranında CO bulunması, 7-10 dakikada ölüme neden olabilir.
Karboksihemoglobin, kana tipik parlak kırmızı renk verir. CO ile zehirlenmenin belirtileri, bilinç kaybı, tırnak dipleri ve mukoz membranların kiraz kırmızısı renk almasıdır. CO ile zehirlenmenin tanısı için kan NaOH ile karıştırılır; normalde koyu kahverengi renk gözlendiği halde CO ile zehirlenme durumunda kiraz kırmızısı renk gözlenir.
CO ile zehirlenme durumlarında temiz hava, kandaki karboksihemoglobinin %5’ini 2-3 saatte uzaklaştırır; hiperbarik oksijen (%95 O2 ve %5 CO2 karışımı), kandaki karboksihemoglobinin %50’sini 15-30 dakikada tamamını ise 30-90 dakikada uzaklaştırır.
Methemoglobin
Methemoglobin, hemoglobindeki Fe2+ ’nin Fe3+ haline reversibl olarak oksitlenmesi sonucu oluşan kahverengi bir hemoglobin bileşiğidir.
Methemoglobin, hemoglobine bazı oksidan etkenlerin etkisi sonucunda oluşur; hemoglobin, oksijen varlığında , yavaşça methemoglobine okside olur. Vücutta çok az ancak sabit miktarda methemoglobin oluşmaktadır; normalde kanda total hemoglobinin %0,5-1’i kadar methemoglobin bulunur. Methemoglobin, O2 ve CO bağlayamaz; kandaki methemoglobin total hemoglobinin %10’undan fazla ise siyanoz görülür; %20’sinden fazla ise ayrıca yorgunluk, baş ağrısı, baş dönmesi, uyuklama, taşikardi gibi hipoksi bulguları ve polisitemi görülebilir.
Methemoglobin, glikoliz sırasında oluşan NADH ve spesifik bir enzim olan methemoglobin redüktaz tarafından indirgenir; insan eritrositlerinden izole edilen methemoglobin redüktazın az miktarda da olsa NADPH kullandığı da gösterilmiştir. Methemoglobin indirgenmezse, methemoglobinemi ve doku anoksisi olur. Methemoglobinemi, herediter ve edinsel olabilir.
Herediter methemoglobinemide iki ayrı defekt olabilir: 1) Methemoglobin redüktazda defekt olabilir. Otozomal resesif kalıtılır. Normalda methemoglobin düzeyi total hemoglobinin % 0,5’i iken, enzim eksikliğinde methemoglobin düzeyi total hemoglobinin % 10-40’ı arasındadır. Tedavi amacıyla, methemoglobini indirgemek için askorbik asit ve metilen mavisi gibi indirgeyici ajanlar verilir. 2) Hemoglobin molekülünde defekt olabilir; methemoglobin redüktaz enziminin hemoglobine bağlanacağı bölgede değişim vardır. Otozomal dominant kalıtılır. Methemoglobinin indirgenmesi, askorbat ve metilen mavisi verilmesine dirençli hale gelir.
Edinsel methemoglobinemi, methemoglobin oluşumunu artırıcı fenasetin, anilin, nitrofenol, aminofenol, sulfanilamid, inorganik ve organik nitrat ve nitritler, klorat, ferrisiyanid, pirogallol, sulfonal, hidrojen peroksit gibi maddelerin alınmasına bağlı olarak ortaya çıkar.
Sulfhemoglobin
Sulfhemoglobin, oksihemoglobin ile H2S’ün reaksiyonlaşması sonucu oluşan yeşil-sarı renkli bir hemoglobin bileşiğidir. Sulfhemoglobinde kükürt atomu, hemoglobindeki demire değil porfirin halkasına kovalent bağlanmıştır. Sülfürlenmiş porfirin halkasına O2 bağlanamaz; hemoglobinin O2’e affinitesi azalır. Sulfhemoglobin, aşırı kabızlık durumlarında bağırsak bakterilerinin proteinlere etkisi ile oluşan H2S’ün kana geçmesi sonucu oluşur; bazı aromatik aminlerin alınışı, kataliz yoluyla sulfhemoglobin oluşumunu artırır. Methemoglobin oluşturan fenasetin, asetanilid, sulfonilamid, lepra tedavisinde kullanılan dapson gibi ilaçlar ve hava kirliliği de sulfhemoglobin oluşumuna neden olabilir.
Ölümden sonra proteinlerin kokuşması sonucu olarak dokularda H2S oluşur ki kadavraların kan toplanan yerlerinde görülen yeşil lekeler buralarda sulfhemoglobin oluşmasının sonucudur..
Azotmonoksit hemoglobin
Azotmonoksit hemoglobin, nitritli dumanların solunması durumlarında oluşan pembe renkli bir hemoglobin bileşiğidir.
Siyanhemoglobin
Siyanhemoglobin, HCN solunması sonucu oluşan bir hemoglobin bileşiğidir.
Siyanmethemoglobin
Siyanmethemoglobin, inorganik siyanür bileşiklerinin ağızdan alınması sonucu oluşan bir hemoglobin bileşiğidir; sellüler enzimlere toksik etkilidir. Siyanür, amigdalin içeren gıdalarla veya Na-nitroprussid, süksinonitril, akrilonitril içeren ilaçlarla ve tütün dumanı ile alınabilir. Siyanür alınması durumunda önce normal hemoglobin methemoglobine dönüşür, sonra siyanürün demirin 6.pozisyonundaki OH ile yer değiştirmesi sonucu siyanmethemoglobin oluşur. Siyanmethemoglobin, hücrelerde normal vücut olayları sırasında elimine edilebilir; karaciğer ve böbrek hücrelerinde mitokondride bulunan rhodanaz (tiyosülfat-siyanid sülfür transferaz) enzimi etkisiyle methemoglobin ve toksik olmayan tiyosiyanata (SCN-) dönüşür.
Hemoglobin tanımlanması ve miktar tayini
İdrar gibi bir biyolojik materyalde hemoglobin, benzidin deneyi ile tanımlanabilir; kanda hemoglobin miktarı, siyanmethemoglobin yöntemi ile tayin edilebilir.
Benzidin deneyi ile idrarda hemoglobin (kan) arama
Hemoglobinin H2O2 ile benzidin arasındaki oksidoredüksiyon reaksiyonunu katalizlemesi prensibine dayanır.
Bir deney tüpüne bazik benzidinin glasiyal asetik asitteki %1’lik taze çözeltisinden 2-3 mL ve aynı miktarda %3’lük H2O2 çözeltisinden konup karıştırılır. Tüpteki karışım üzerine damla damla idrar eklenip karıştırılır; yeşil veya mavi-yeşil renk oluşup oluşmadığına bakılarak sonuç rapor edilir: Tüpte yeşil veya mavi-yeşil renk oluşumu gözlenmezse idrarda hemoglobin (-)’dir. Tüpte yeşil veya mavi-yeşil renk oluşumu gözlenirse idrarda hemoglobin (+)’dir.
Açıklama: İdrarda hemoglobin varlığında; benzidin ile H2O2 arasında oksidoredüksiyon reaksiyonu hızlanır; H2O2 suya indirgenirken benzidin yükseltgenir. Ortamdaki yükseltgenmiş benzidin ile henüz yükseltgenmemiş benzidin karışımı, benzidin mavisi diye bilinen mavi-yeşil bir renk oluşturur.
İdrarda lökosit varlığında bunlardaki peroksidazın etkisiyle yalancı (+) sonuç elde edilir; ancak idrar kaynatılırsa, peroksidazın etkisi ortadan kaldırılabilir. Çok fazla miktarda kullanılan vitamin C ise hemoglobinin etkisini önler ve yalancı (-) sonuca neden olabilir. İdrarda az miktarda hemoglobin bulunması durumunda fazla damlatılan idrar benzidini çökeltir ve bu durumda yalancı (-) sonuç elde edilir.
Siyanmethemoglobin yöntemi ile hemoglobin miktar tayini
Siyanmethemoglobin yöntemi ile hemoglobin miktar tayini deneyinde önce hemoglobin, K3Fe(CN)6 çözeltisi ile ferrihemoglobin şekline dönüştürülür; daha sonra ferrihemoglobin CN- ile reaksiyonlaştırılarak stabil olan siyanmethemoglobine çevrilir. Oluşan siyanmethemoglobin kolorimetrik olarak ölçülür ve standart ile karşılaştırılarak hemoglobin miktarı bulunur.
Miyoglobin
Miyoglobin, prostetik grubu hem olan bir kromoproteindir; başlıca kırmızı kaslarda özellikle kalp kasında yüksek konsantrasyonda bulunur; miyokartta 1,4 mg/g doku kadar bulunur. Miyoglobin, 153 amino asitten oluşan bir polipeptit zinciri ve bir hem grubu içerir:
Miyoglobin, proteinlerin tersiyer yapısına iyi bir örnektir. Miyoglobinin globin zincirinde sekiz a-heliks segmenti bulunur; hepsi sağa dönüşlüdür; en kısası 7 ve en uzunu 23 amino asitten oluşur; A’dan H’ye kadar harflerle isimlendirilirler. Prostetik hem grubu, F ve E heliksler arasında bulunur. Hem grubu yapısındaki demir, Fe2+ şeklindedir; demir, dört bağını pirol halkalarıyla, 5.bağını F8 histidinle yapar. F8’in karşısındaki E7 histidin hem ile bağ yapmaz. Miyoglobin, hem grubu nedeniyle kırmızı kahverenklidir; miyoglobinden zengin kaslar kahverengi renkli olur.
Miyoglobinin hem grubundaki Fe2+, O2 ile reversibl olarak bağlanabilir. Demir, oksijen bağlanmadan önce halka düzleminin biraz dışında yer alır; oksijen bağlandığında bu düzleme doğru hareket eder. Oksijen ile demir arasındaki bağ, hem halka düzlemi ile 121 derece açı yapacak şekilde oluşur. Karbonmonoksit ile demir bağı hem düzlemine dik olursa 25.000 kez güçlü olur; ancak E7 histidin karbonmonoksidin bu açı ile bağlanmasına engel olur ve hem ile karbonmonoksit arasındaki bağın gücü 200 kata düşer. Normal fizyolojik koşullarda miyoglobinin %1’i karbonmonoksit bağlamış olarak bulunur.
Miyoglobine bağlanan oksijen miktarı da yüzde satürasyon olarak ifade edilir; hem demirinin o sırada içinde bulunduğu ortamın oksijen konsantrasyonuna veya parsiyel oksijen basıncına (pO2) bağlıdır. pO2 ve miyoglobine bağlı O2 miktarı arasındaki ilişki grafik olarak oksijen satürasyon (oksijen dissosiasyon) eğrisi ile ifade edilebilir ki bu eğri hiperboliktir:
Akciğerlerdeki kapiller yatağın pO2’si 100 mmHg olduğuna göre miyoglobin akciğerlerde oksijeni etkin olarak bağlayabilir. Ancak venöz kanın pO2’si 40 mmHg ve aktif kasınki 20 mmHg’dır; miyoglobin kendisine bağlı oksijenin büyük kısmını 20 mmHg pO2’da dahi veremeyeceğinden akciğerlerden periferik dokulara oksijen taşınmasında etkin bir araç olamaz. Miyoglobinin oksijen ile yarı yarıya doymuş olduğu kısmi oksijen basıncı (P50), 1 mmHg kadardır. Miyoglobinin oksijene affinitesi, hemoglobinin oksijene affinitesinden fazladır. Ancak ağır egzersizden sonra oksijenin azaldığı durumlarda kas dokusunun pO2’si 5 mmHg’ya kadar düşebilir ve miyoglobin kas mitokondrisinde ATP’nin oksidatif sentezi için kendisine bağlı oksijeni derhal serbest bırakır; miyoglobin, kasta bir çeşit oksijen deposu olarak işlev görür.
Fok gibi yaşam alışkanlıkları dolayısıyla uzun süre su altında kalan memelilerde miyoglobin miktarı yüksektir.
Kaslarda bol miktarda bulunan miyoglobin, kas yaralanmalarında kana geçer ve idrarla atılır ki idrarla miyoglobin atılması miyoglobinüri olarak tanımlanır; klinik tanı açısından önemlidir.
Sitokromlar
Sitokromlar, prostetik grup olarak bir demir-porfirin bileşiği olan hem içeren elektron taşıyıcı proteinlerdir; mitokondrilerin iç membranlarında bulunurlar.
Sitokromlar, prostetik grupları olan hem vasıtasıyla oluşturulan karakteristik koyu renklere sahiptirler; her sitokrom tipi, indirgenmiş durumunda, görünür ışık spektrumunda (390-780 nm) üç absorpsiyon bandına sahiptir. Sitokromlar, ışık absorpsiyon spektrumlarındaki farklılıklara göre sitokrom a, sitokrom b ve sitokrom c olmak üzere üç sınıfa ayrılırlar.
En uzun dalga boyundaki absorpsiyon bandı olan a bandı, sitokrom a’larda 600 nm’ye yakın, sitokrom b’lerde 560 nm’ye yakın, sitokrom c’lerde 550 nm’ye yakındır. Bazen bu banda ait kesin dalga boyu sitokromun adında kullanılır. Örneğin sitokrom b562, a bandının 562 nm’de saptandığını ifade eder:
Sitokrom a ve sitokrom b’de hem grupları, ilişkili proteinlere sıkıca fakat nonkovalent olarak bağlanmışlardır; sitokrom c’de ise sistein kalıntıları vasıtasıyla kovalent olarak bağlanmışlardır.
E-Kaynak: www.mustafaaltinisik.org.uk/89-1-11.pdf






































Hiç yorum yok:
Yorum Gönder